医疗器械软件临床试验服务是道和思源联合国内医疗器械软件临床试验顶尖专家以及知名医院重点打造的核心业务之一。医用软件临床试验是部分二三类医疗器械软件注册流程中最为关键的一环,它需要得到专业知识、庞大资金以及充足时间来支持。道和思源拥有顶尖的医用软件临床试验专家,拥有各类医疗器械软件产品多年临床试验服务经验,具备完善的医疗器械软件临床全过程管理能力,以及严谨的项目评估能力,为您提供高效率、降成本、保质...
医疗器械软件临床试验服务是道和思源联合国内医疗器械软件临床试验**专家以及知名医院重点打造的核心业务之一。医用软件临床试验是部分二三类医疗器械软件注册流程中最为关键的一环,它需要得到专业知识、庞大资金以及充足时间来支持。道和思源拥有**的医用软件临床试验专家,拥有各类医疗器械软件产品多年临床试验服务经验,具备完善的医疗器械软件临床全过程管理能力,以及严谨的项目评估能力,为您提供高效率、降成本、保质量的医疗器械软件临床试验服务。
(1)项目可行性调研; (2)伦理递交;
(3)研究者会议组织; (4)受试者招募;
(5)研究中心信息收集; (6)试验预算管理;
(7)研究相关培训; (8)内部稽查;
(9)临床试验项目管理; (10)试验物资和试验文件管理。
(1)临床试验管理; (2)专业临床研究协调员(CRC)配备;
(3)研究文档的管理; (4)受试者招募与管理;
(5)研究物资管理; (6)数据管理;
(7)伦理和机构的沟通; (8)安全信息的管理;
(9)研究中心管理; (10)研究中心SOP的建立和完善;
(11)机构认证辅导; (12)研究者及其他参与人员的培训;
(13)协助机构对在研项目的稽查; (14)协助接受SFDA现场核查;
(15)费用协商。
1.预期的受益应当大于可能出现的损害。
2.完成医疗器械临床前研究。
3.准备充足的试验用医疗器械。
4.医疗器械临床试验应当在两个或两个以上医疗器械临床试验机构中进行。
5.申办者与临床试验机构和研究者达成书面协议。
6.列入需进行临床试验审批的第三类医疗器械目录产品的临床试验需获得批准。
7.申办者应向所在省、自治区、直辖市食品药品监督管理部门备案。
临床试验方案包括:
1. 一般信息
2. 临床试验的背景资料
3. 试验目的
4. 试验设计
5. 安全性评价方法
6. 有效性评价方法
伦理委员会意见
临床试验方案
临床试验报告
具体内容详见《医疗器械临床评价技术指导原则》
1. 临床试验审批定义
对人体具有较高风险的第三类医疗器械进行临床试验应获得国务院药品监督管理部门批准。
2. 需进行临床试验审批的第三类医疗器械目录
国家药监局关于发布需进行临床试验审批的第三类医疗器械目录(2020年修订版)的通告(2020年第61号)
3. 临床试验审批流程
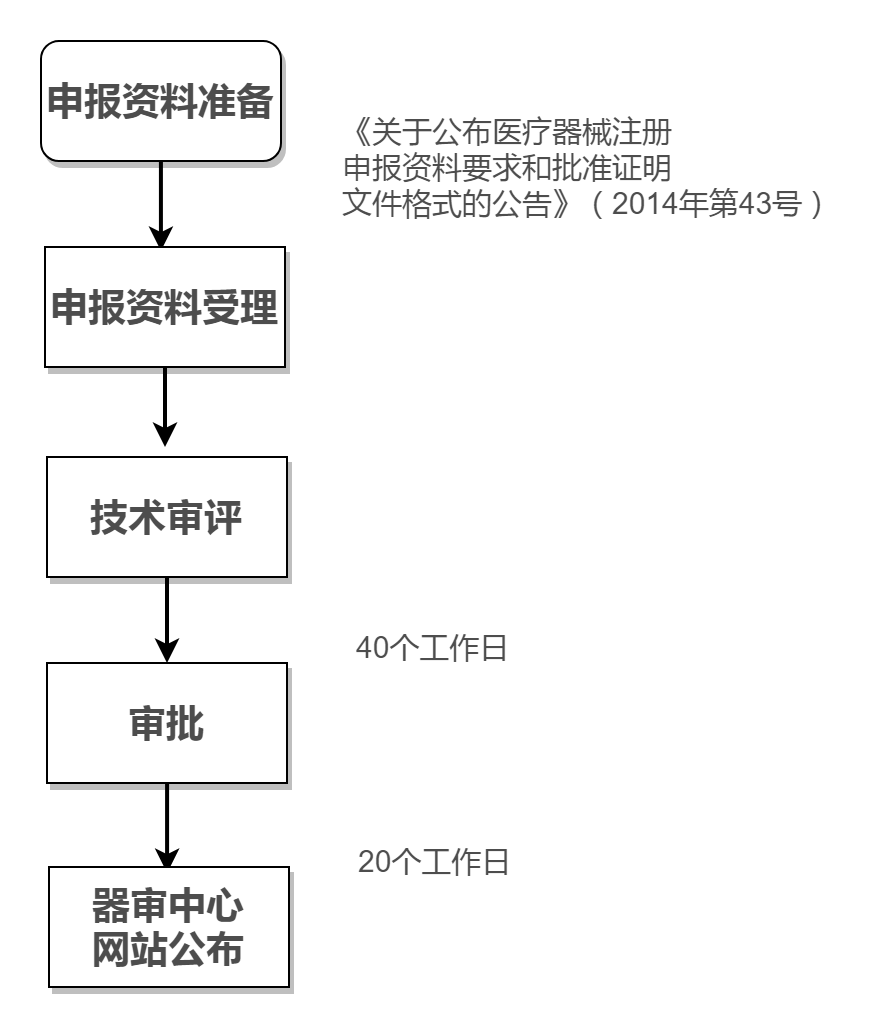

该费用根据产品具体情况来报价,如需产品报价,可直接联系李经理13521090701
临床时间是根据产品具体情况来规划时间的,如需临床试验时间,可直接联系李经理13521090701